Les immunothérapies cellulaires, ces traitements au potentiel immense, reposent sur un principe ultrasimple. Elles consistent à reprogrammer certaines cellules immunitaires du patient, en les réarmant pour qu’elles détruisent des cellules nocives, impliquées dans des cancers ou des maladies auto-immunes, par exemple.
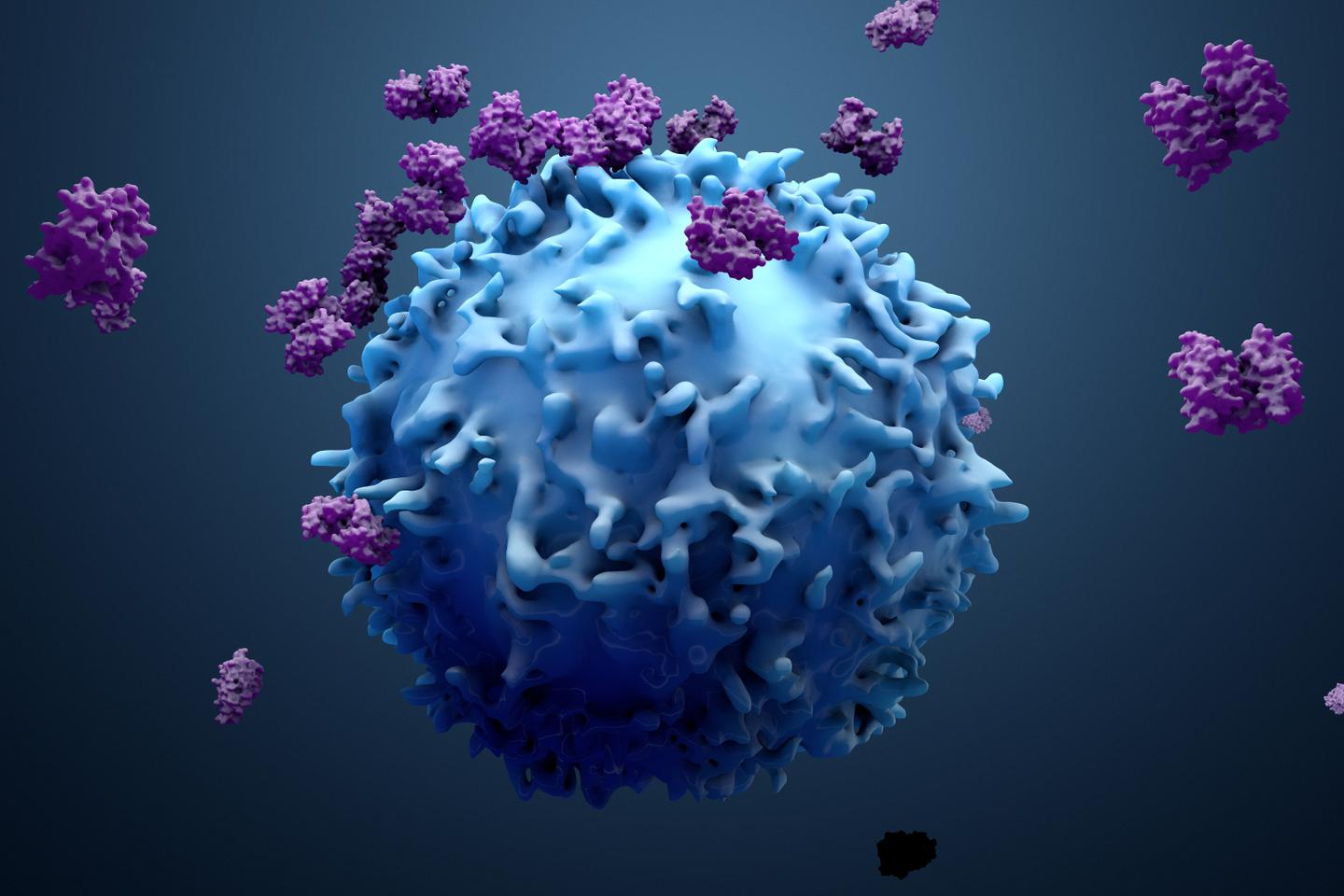
Une de ces stratégies, utilisée avec succès dans des cancers du sang, repose sur les « cellules CAR-T ». Ici, les lymphocytes T, une catégorie de globules blancs, sont prélevés dans le sang de chaque patient. Puis on leur délivre in vitro une instruction génétique, qui leur intime l’ordre de produire une protéine de surface : le CAR, ou récepteur chimérique de l’antigène. C’est, en clair, un récepteur artificiel conçu pour se lier à une protéine (un « antigène ») portée par les cellules tumorales du patient. Par exemple, à la protéine CD19, présente en excès sur les lymphocytes B dans certains lymphomes ou leucémies.
Une fois réinjectées au patient, ces cellules CAR-T se comportent en missiles à tête chercheuse. Grâce à leur fameux CAR, elles se lient spécifiquement à l’antigène présent sur les cellules tumorales, qu’elles éliminent. Autre atout : parce que ce sont des cellules vivantes, elles prolifèrent dans l’organisme du patient, où elles opèrent « tant qu’il reste du cancer à détruire », expliquait au Monde, en 2024, Michel Sadelain, pionnier de cette approche au Memorial Sloan Kettering Cancer Center, à New York. A ce jour, sept thérapies par cellules CAR-T ont été approuvées aux Etats-Unis et en Europe contre certains lymphomes, myélomes ou leucémies. La stratégie fait aussi l’objet d’essais cliniques précoces dans des tumeurs solides et des maladies auto-immunes.
Il vous reste 65.34% de cet article à lire. La suite est réservée aux abonnés.