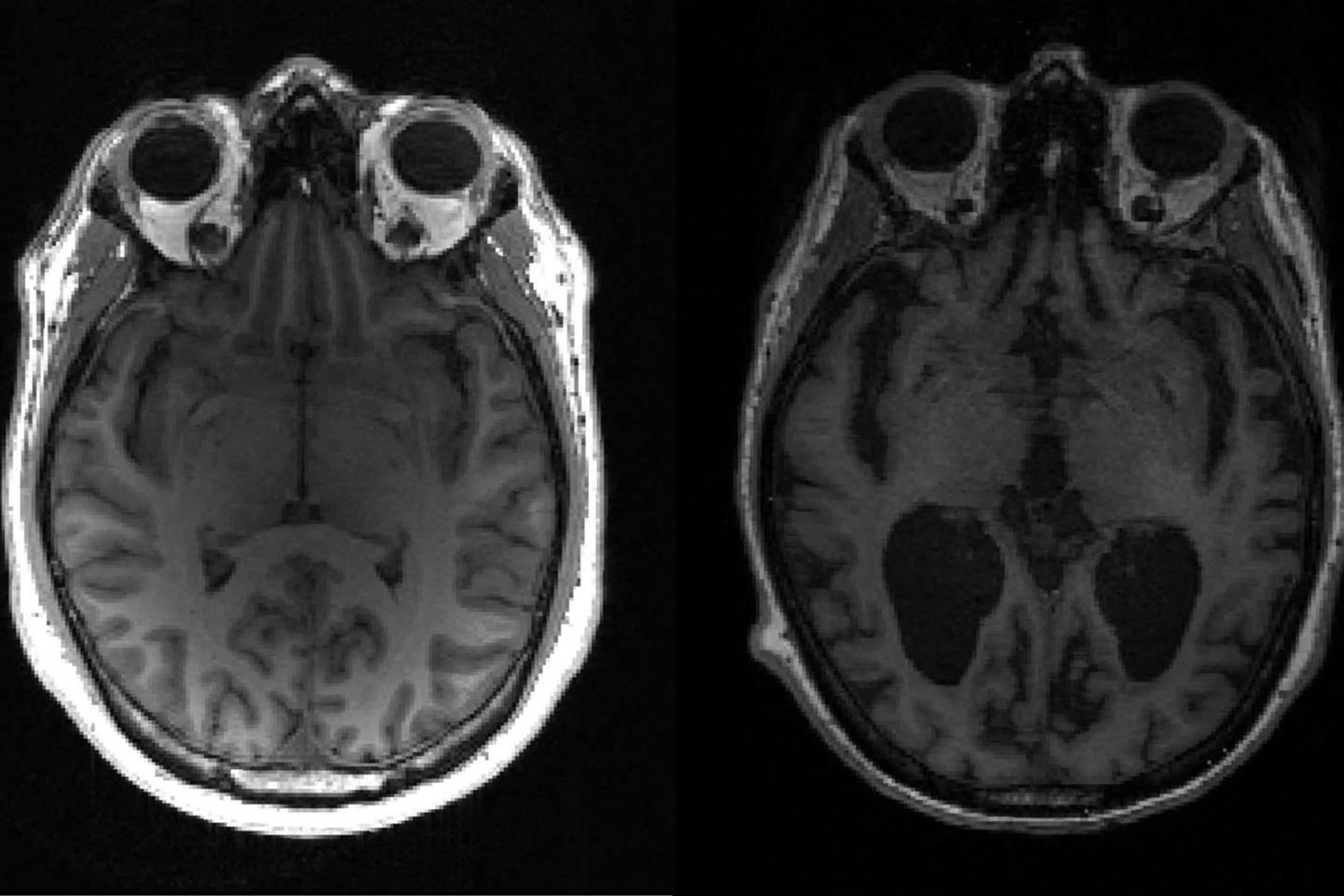
La protéine tau a mauvaise réputation : on la retrouve sous forme d’agrégats dans des maladies dégénératives comme celle d’Alzheimer. Sous sa forme non pathologique, elle intervient, notamment dans les neurones, dans la stabilisation des microtubules, des structures essentielles à l’architecture et au transport moléculaire au sein de nos cellules.
Mais il arrive qu’elle prenne une conformation spéciale, qui l’amène à conférer aux autres molécules tau la même configuration en trois dimensions pour former, en cascade, des agrégats délétères, caractéristiques des tauopathies. C’est pourquoi elle est décrite comme faisant partie des molécules « prion like », car ces mécanismes d’agrégation ont d’abord été observés dans des maladies à prions comme celle de Creutzfeldt-Jakob ou de la vache folle.
Quelles sont les conditions minimales pour enclencher cette réaction en chaîne de mauvais repliements ? C’est la question que se sont posée Songi Han (Northwestern University, Illinois) et ses collègues. Dans la revue PNAS du 28 avril, ils décrivent ce qu’ils qualifient de « miniprion synthétique », reproduisant une petite partie de la protéine tau. Cette molécule ne comprend que 19 acides aminés, contre 758 dans la protéine entière. Et elle présente une mutation, dite « P301L », que l’on observe par exemple dans la démence fronto-temporale, une tauopathie qui peut prendre une forme héréditaire.
Il vous reste 63.33% de cet article à lire. La suite est réservée aux abonnés.