C’est l’histoire d’une femme de 25 ans qui veut guérir de son cancer sans renoncer à devenir mère un jour. Tout commence par une dyspareunie sévère : des douleurs intenses lors des rapports sexuels qui la poussent à consulter. Elle n’a aucun antécédent médical notable et n’a jamais été enceinte.
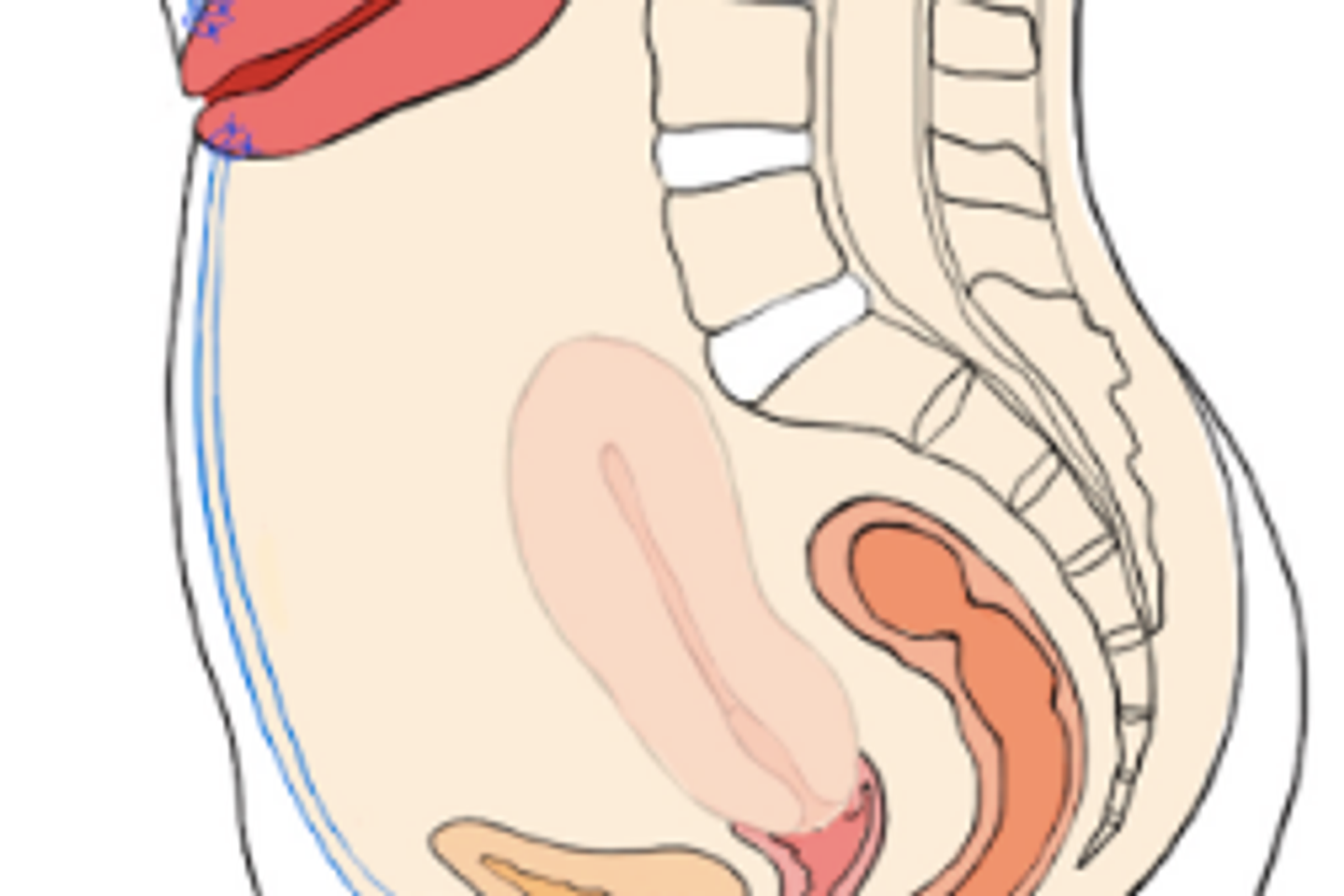
Les examens d’imagerie révèlent une masse impressionnante, de près de 9 cm de diamètre, située en arrière de l’utérus, dans la cloison séparant le vagin et le rectum. L’examen au spéculum est impossible, tant la tumeur fait saillie dans le vagin. La rectosigmoïdoscopie, qui permet de visualiser les parois du rectum et du côlon sigmoïde, confirme en revanche l’absence d’atteinte rectale.
Une biopsie réalisée par voie vaginale permet de poser le diagnostic : il s’agit d’un sarcome d’Ewing extra-osseux, une tumeur maligne rare appartenant à la famille des sarcomes d’Ewing. Ces cancers agressifs touchent surtout les adolescents et les jeunes adultes et siègent habituellement dans l’os. La forme extra-squelettique, beaucoup plus rare – environ 0,4 cas par million d’habitants – est toutefois associée à un meilleur pronostic.
La prise en charge débute par une chimiothérapie. Après quatre cycles, une nouvelle IRM montre une nette réduction du volume tumoral : la masse ne mesure plus qu’environ 5 cm sur son plus grand axe. Une chirurgie d’exérèse est alors programmée, suivie d’une chimiothérapie adjuvante et d’une radiothérapie.
Une chirurgie hors norme pour préserver la possibilité de maternité future
Mais la radiothérapie expose à un risque majeur d’infertilité, même à doses modérées. Les ovocytes sont en effet extrêmement radiosensibles : une dose de 2 Gray (Gy) suffit à détruire jusqu’à la moitié du stock d’ovocytes. L’utérus n’est pas épargné : diminution de volume, perte de souplesse liée à la fibrose du muscle utérin, atteinte de la vascularisation et lésions de l’endomètre, la muqueuse qui tapisse la cavité utérine.
Les options de préservation de la fertilité chez les femmes devant recevoir une
irradiation pelvienne restent peu nombreuses, difficiles d’accès et d’efficacité limitée. Les stratégies habituellement proposées – congélation d’ovocytes ou d’embryons, transposition des ovaires hors du champ d’irradiation afin d’éviter une ménopause radio-induite – ne protègent pas l’utérus et conduisent souvent à envisager une gestation pour autrui, interdite en France. Pour cette jeune femme exprimant un fort désir de grossesse, l’équation est donc particulièrement complexe.
Remonter l’utérus et les ovaires dans la partie supérieure de l’abdomen
L’équipe chirurgicale lui propose alors une stratégie exceptionnelle : une transposition temporaire de l’utérus et des ovaires. Le principe consiste à repositionner ces organes hors du champ de la future irradiation pelvienne, puis à les réimplanter une fois les traitements terminés. Concrètement, l’utérus et les ovaires sont remontés dans la partie supérieure de l’abdomen, loin de leur position anatomique habituelle, afin de les protéger des rayonnements.
La patiente bénéficie ainsi d’une chirurgie oncologique hors norme. L’intervention associe l’exérèse en bloc de la tumeur, du rectum et de la paroi postérieure du vagin, tout en repositionnant temporairement l’utérus et les ovaires pour les mettre à l’abri des effets de la radiothérapie à venir.
Les chirurgiens doivent déplacer l’utérus et les ovaires hors du bassin, là où sera délivrée la radiothérapie, sans jamais les débrancher complètement de leur alimentation sanguine.
En temps normal, l’utérus est relié au bassin par plusieurs vaisseaux sanguins. Certains sont volontairement sectionnés, mais les chirurgiens prennent soin de préserver les principaux circuits d’irrigation passant par les ovaires, via les ligaments qui les relient à l’utérus. Ces structures contiennent des vaisseaux essentiels, capables d’assurer une circulation sanguine suffisante malgré le déplacement vers le haut de l’abdomen.
Une fois ces connexions sécurisées, l’utérus, les trompes et les ovaires sont déplacés ensemble vers le haut de l’abdomen, à distance de la zone à irradier. Le col de l’utérus est solidement fixé près du nombril afin de stabiliser l’ensemble, sans exercer de tension excessive sur les vaisseaux. Les ovaires sont positionnés avec précaution, en évitant toute torsion des pédicules vasculaires.
Ce n’est qu’après ce repositionnement que les chirurgiens s’attaquent à la tumeur elle-même. Celle-ci est retirée en un seul bloc afin de limiter au maximum le risque de dissémination de cellules cancéreuses. Cette exérèse large impose l’ablation du rectum ainsi que d’une grande partie de la paroi postérieure du vagin. La continuité du tube digestif est ensuite rétablie en raccordant le côlon au canal anal. Par mesure de sécurité, le temps que cette suture cicatrise, une dérivation temporaire des selles est mise en place (iléostomie de protection, sorte d’« anus artificiel » provisoire).
Le vagin est reconstruit à l’aide d’un lambeau d’épiploon, un tissu graisseux bien vascularisé prélevé dans l’abdomen, façonné pour remplacer la paroi vaginale manquante.
Enfin, le col de l’utérus est fixé à la paroi abdominale, près du nombril, à l’aide de huit points de suture résorbables. Cet ancrage ombilical suffit à maintenir l’utérus en bonne position ; aucune fixation supplémentaire du corps utérin n’est nécessaire.
Parallèlement, les chirurgiens installent dans le bassin une prothèse gonflable temporaire pour repousser l’intestin hors du futur champ d’irradiation. Il s’agit d’un expanseur mammaire, habituellement utilisé en chirurgie reconstructrice du sein. Ici, il sert à combler l’espace laissé vide et à maintenir les anses intestinales à distance des rayonnements, une stratégie encore rarement décrite dans la littérature médicale. Ce dispositif réduit la dose de radiations reçue par les organes digestifs, limitant les effets secondaires immédiats et tardifs. Sa composition équivalente à l’eau n’altère pas les images médicales, facilitant la visualisation des organes à protéger et le calcul précis des doses de radiothérapie.
Après l’intervention, l’équipe surveille quotidiennement l’aspect du col de l’utérus, désormais visible au niveau du nombril. Deux jours après l’opération, une échographie Doppler des vaisseaux ovariens confirme que la circulation sanguine vers l’utérus est normale.
La patiente quitte l’hôpital sept jours plus tard. Au 21ᵉ jour, les médecins remarquent une petite zone superficielle du col utérin en souffrance ischémique : elle manque temporairement d’irrigation sanguine, sans provoquer de symptôme.
Un mois après la chirurgie, les règles réapparaissent, signe que l’utérus, bien que déplacé en position haute, reste fonctionnel. Les médecins décident alors de suspendre volontairement les menstruations par un traitement hormonal (Décapeptyl), pour mettre les ovaires au repos pendant la suite des traitements.
La radiothérapie est administrée à une dose totale de 54 Gy, répartie en 30 séances de 1,8 Gy. Elle est associée à une chimiothérapie, sous forme de cinq cures alternées. À l’issue de l’ensemble du traitement, un PET-scan, un scanner thoraco-abdomino-pelvien et une IRM ne montrent plus aucun signe de maladie.
L’utérus réintègre son emplacement originel quatre mois après la fin de la chimiothérapie
Trois mois après la fin de la chimiothérapie, une nouvelle intervention est programmée par ouverture médiane de l’abdomen. L’objectif est double : remettre l’utérus dans le pelvis et fermer l’iléostomie de protection. Avant l’opération, une angiographie confirme que les artères ovariennes sont toujours perméables.
Les chirurgiens commencent par retirer la prothèse d’expansion qui occupait le petit bassin. Ils décollent ensuite le col de l’utérus de la paroi abdominale au niveau de l’ombilic afin de pouvoir redescendre l’utérus dans le pelvis. Certains tissus du col, devenus atrophiques et fibrosés, sont retirés. L’orifice interne du col est ensuite progressivement dilaté à l’aide de bougies métalliques afin de recréer un canal cervical bien perméable.
En injectant un colorant bleu dans la cavité utérine, l’équipe vérifie que l’utérus communique toujours avec au moins une trompe. Le col restant est abaissé et suturé au sommet du vagin, rétablissant une continuité anatomique fonctionnelle.
Les suites opératoires sont compliquées par un syndrome inflammatoire persistant et des douleurs abdominales. Un scanner met en évidence plusieurs abcès le long de la cicatrice abdominale, qui sont drainés et traités par antibiotiques. L’évolution clinique et biologique devient ensuite favorable, permettant un retour à domicile au 14ᵉ jour postopératoire.
Quatre mois après la réimplantation, l’IRM montre un utérus d’aspect normal, mais une rétention de sang liée à de petites adhérences vaginales entravant l’écoulement des règles. Une dilatation progressive permet de lever cet obstacle et de rétablir un flux menstruel normal.
Perspective de grossesse possible après la fin de la surveillance oncologique
« Un an après l’intervention, l’utérus présente une taille normale, une vascularisation satisfaisante et une épaisseur endométriale adéquate, favorisant une capacité potentielle à mener une grossesse ultérieure », déclarent Cherif Akladios, Floriane Jochum, Lise Lecointre et leurs collègues du service de gynécologie oncologique des hôpitaux universitaires de Strasbourg. Leur article, publié en ligne dans le Journal of Gynecology Obstetrics and Human Reproduction, paraîtra dans le numéro de février 2026.
Lorsque la surveillance oncologique aura confirmé l’absence de récidive, un bilan hormonal complet sera réalisé, incluant le dosage de l’hormone anti-müllérienne (AMH). Ce marqueur biologique permet d’estimer la réserve ovarienne, c’est-à-dire le capital d’ovocytes restant après les traitements. Ce bilan est programmé deux ans après la chirurgie, avant toute tentative de grossesse.
Il s’agit du premier cas français de transposition utérine réalisée dans un objectif de préservation de la fertilité. C’est également le premier cas décrit chez une patiente atteinte d’un sarcome d’Ewing extra-squelettique.
Dix-huit cas de transposition utérine dans le monde
La transposition utérine ouvre un champ nouveau : celui d’une prise en charge
oncologique qui ne vise pas seulement à traiter le cancer, mais aussi à préserver la fertilité. Cette procédure s’adresse à des femmes soigneusement sélectionnées : jeunes, sans métastases, avec un bon pronostic et un désir de grossesse clairement exprimé.
Elle requiert une coordination étroite entre oncologues, chirurgiens, radiothérapeutes, radiologues et spécialistes de la fertilité, car elle modifie profondément l’anatomie pelvienne et impose une planification de la radiothérapie entièrement personnalisée.
Entre 2017 et 2024, dix-huit cas de transposition utérine, réalisées chez des patientes âgées de 3 à 38 ans (âge médian : 15 ans) ont été rapportés dans la littérature médicale internationale. La plupart des cas concernent des cancers digestifs ou gynécologiques. Dans 16 cas sur 18, l’intervention a été réalisée par cœlioscopie, dont un avec assistance robotique ; une seule fois, comme à Strasbourg, par laparotomie, c’est-à-dire par ouverture de la paroi abdominale.
À l’exception d’une patiente décédée de récidive quatre mois après la transposition, toutes sont aujourd’hui en vie et sans signe de maladie. Chez toutes les patientes évaluables, la fonction ovarienne est restée normale. La fonction utérine, définie par la reprise de règles régulières, a été préservée chez 14 femmes sur 16 (87,5 %).
Des bébés nés après transposition utérine
En 2023, le Dr Reitan Ribeiro (Curitiba, Brésil) a rapporté dans la revue Fertility and Sterility la première naissance vivante après transposition utérine chez une patiente de 26 ans atteinte d’un adénocarcinome du rectum avec atteinte ganglionnaire. La grossesse s’est déroulée sans complication majeure. L’enfant, né par césarienne à 36 semaines, était en bonne santé et pesait 2,6 kg.
La deuxième naissance après transposition utérine a été rapportée quelques mois plus tard par une équipe péruvienne en association avec le chirurgien brésilien. Elle a été marquée par un retard de croissance intra-utérin sévère et une hypotrophie néonatale. L’accouchement a eu lieu à 36 semaines, avec un poids de naissance de 2,5 kg.
En mai 2025, en Suisse, une patiente traitée pour un cancer du rectum a donné naissance à un enfant à Sion (Valais) après avoir bénéficié d’une transposition utérine afin de préserver sa fertilité. Il s’agit d’une première en Europe.
À ce jour, il semble que six grossesses ont été menées à terme chez des femmes ayant bénéficié d’une transposition utéro-ovarienne suivie d’une réimplantation de l’utérus. Ces naissances ont été rapportées au Brésil, au Pérou, en Argentine, aux États-Unis et en Suisse. Le suivi a montré un développement normal des enfants.
Ces cas illustrent ce que la médecine et la chirurgie peuvent aujourd’hui accomplir : non seulement sauver une vie, mais aussi préserver un projet de vie.
Pour en savoir plus :
Akladios C, Boisramé T, Martel C, et al. Uterine transposition for fertility preservation in extra-skeletal ewing sarcoma : the first French case report. J Gynecol Obstet Hum Reprod. 2025 Dec 15 ; 55 (2) : 103088. doi : 10.1016/j.jogoh.2025.103088
Bizzarri N, Chiloiro G, Innocenzi C, et al. Robotic-assisted uterine transposition for fertility preservation in patients treated with radiotherapy for pelvic malignancies : from transposition to repositioning. Int J Gynecol Cancer. 2025 Nov 8 ; 36 (1) : 102794. doi : 10.1016/j.ijgc.2025.102794
Pavone M, Waeldin L, Seeliger B, et al. Fertility-sparing uterine displacement for pelvic malignancies : surgical options and radiotherapy dosimetry on a human cadaver. World J Surg Oncol. 2024 Jun 3 ; 22 (1) : 147. doi : 10.1186/s12957-024-03423-4
Pavone M, Autorino R, Bizzarri N, et al. Uterine transposition versus uterine ventrofixation before radiotherapy as a fertility sparing option in young women with pelvic malignancies : Systematic review of the literature and dose simulation. Eur J Surg Oncol. 2024 Jan ; 50 (1) : 107270. doi : 10.1016/j.ejso.2023.107270
Ribeiro R, Baiocchi G, Obermair A, et al. Uterine transposition for fertility preservation in pelvic cancers. Int J Gynecol Cancer. 2024 Mar 4 ; 34 (3) : 403-408. doi : 10.1136/ijgc-2023-004992
Laufer J, Scasso S, Kimelman D, et al. Uterine transposition in a patient with vulvar cancer. Gynecol Oncol Rep. 2024 Feb 14 ; 52 : 101337. doi : 10.1016/j.gore.2024.101337
Ribeiro R, Baiocchi G, Moretti-Marques R, et al. Uterine transposition for fertility and ovarian function preservation after radiotherapy. Int J Gynecol Cancer. 2023 Dec 4 ; 33 (12) : 1837-1842. doi : 10.1136/ijgc-2023-004723
Lopez A, Perez Villena JF, Guevara Jabiles A, et al. Uterine transposition and successful pregnancy in a patient with rectal cancer. Int J Gynecol Cancer. 2023 Aug 7 ; 33 (8) : 1310-1315. doi : 10.1136/ijgc-2023-004661
Gornet M, Kao L, Christianson MS, Rehmer J. First live birth after uterine transposition : giving life to uterine-focused fertility preservation. Fertil Steril. 2023 Jul ; 120 (1) : 194-195. doi :
10.1016/j.fertnstert.2023.05.002
Ribeiro R, Anselmi MC, Schneider GA, et al. First live birth after uterine transposition. Fertil Steril. 2023 Jul ; 120 (1) : 188-193. doi : 10.1016/j.fertnstert.2023.02.033
Vieira MA, Vieira AGS, Fonseca DSL, et al. Uterine transposition in a pre-pubertal patient. Int J Gynecol Cancer. 2021 Mar ; 31 (3) : 492-493. doi : 10.1136/ijgc-2020-002074
Marques RM, Tsunoda AT, Dias RS, et al. Robotic uterine transposition for a cervical cancer patient with pelvic micrometastases after conization and pelvic lymphadenectomy. Int J Gynecol Cancer. 2020 Jun ; 30 (6) : 898-899. doi : 10.1136/ijgc-2020-001250
Baiocchi G, Mantoan H, Chen MJ, Faloppa CC. Uterine transposition after radical trachelectomy. Gynecol Oncol. 2018 Aug ; 150 (2) : 387-388. doi : 10.1016/j.ygyno.2018.05.009
Ribeiro R, Rebolho JC, Tsumanuma FK, et al. Uterine transposition : technique and a case report. Fertil Steril. 2017 Aug ; 108 (2) : 320-324.e1. doi : 10.1016/j.fertnstert.2017.06.016



